Comment les flux forment les biofilms bactériens

Vestiges de biofilms de cyanobactéries (stromatolites) dans la Shark Bay World Heritage Area, en Australie. © Philippe Barraud
Des biophysiciens de l'EPFL ont porté un regard systématique sur la manière dont les biofilms bactériens sont affectés par un flux liquide. Ce qu'ils ont trouvé peut nous donner des indications sur les règles physiques qui régissent l'architecture des biofilms, mais aussi sur les dynamiques sociales qui définissent l'évolution.
Bien que nous ayons tendance à les penser comme des hôtes solitaires du monde, les bactéries sont en réalité des organismes très sociaux. La très grande majorité d’entre elles vit sur des surfaces en formant des «biofilms», des communautés tridimensionnelles réunissant des centaines de millions de bactéries dont l’activité est si trépidante que les scientifiques les décrivent comme des «cités bactériennes».
Les bactéries forment des biofilms en s’attachant les unes aux autres sur une grande variété de surfaces: le fond des océans, des lacs et des rivières, les équipements médicaux ou même les organes internes tels que l’intestin, les poumons, les dents – il s’agit dans ce dernier cas de la fameuse plaque dentaire, une grande source de revenus pour les dentistes.
En résumé, les biofilms sont le mode de vie préféré des bactéries. Elles croissent et s’étendent en largeur et en épaisseur, formant ainsi une nouvelle dynamique sociale parmi leurs membres micro-organismes, tout en les défendant aussi: les biofilms peuvent être notoirement inaccessibles aux antibiotiques, et c’est pourquoi ils ont suscité beaucoup de recherche médicale.
Des interactions sociales un peu forcées
Mais le fait d’observer les biofilms peut aussi nous donner des indications sur les dynamiques sociales plus larges qui ont façonné l’évolution des espèces sur la planète entière, comme la coopération, la compétition, etc. Et ce sont ces questions qui motivent le travail d’Alexandre Persat, directeur du Microbial Mechanics Lab de l’EPFL.
«A peu près 90% de la vie bactérienne à la surface de la Terre se trouve sous forme de biofilm», dit-il. «Comme ces structures sont si denses, elles rapprochent de nombreuses espèces, ce qui les fait interagir socialement et, en conséquence, provoque l’évolution. Le résultat d’interactions sociales telles que la compétition et la coopération dépend donc de l’arrangement spatial de ces cellules. Mais ce qui conditionne l’architecture et l’organisation des cellules dans les biofilms, par exemple pour se mélanger ou se séparer, demeure peu clair».
Dans une nouvelle étude, Tamara Rossy, doctorante auprès du groupe d’Alexandre Persat, élargit notre regard sur les biofilms en observant comment les signaux physiques affectent leur développement – plus spécifiquement, comment ils sont affectés par l’écoulement du fluide environnant. «Que ce soit dans les océans, les infections pulmonaires, la peau ou le microbiote de l’intestin, la physique des fluides est présente partout dans les biofilms», explique Tamara Rossy. Nous voulions étudier comment le flux change leur organisation spatiale.»
Pour y parvenir, la chercheuse a d’abord dû créer un biofilm modèle qui puisse être étudié dans des conditions de flux contrôlables. Elle a choisi deux différents clones de la bactérie Caulobacter crescentus, que l’on trouve communément dans les lacs d’eau douce et les rivières, et passe par une étape qui lui permet de s’ancrer sur des surfaces, les coloniser et former des biofilms. Tamara Rossy a fait croître les bactéries dans des puces microfluidiques à l’intérieur desquelles elle pouvait contrôler soigneusement de minuscules quantités de liquide coulant dans des canaux larges d’à peine un millimètre.
Elle a ainsi mis en images la formation de biofilms au niveau d’une seule bactérie, pour mesurer les effets de chaque intensité de flux sur les colonies bactériennes. Les résultats ont montré des différences considérables dans l’architecture sous différents flux: dans des flux faibles, les biofilms étaient très denses. Dans des flux plus forts, les bactéries croissaient en biofilms dispersés, en forme d’agrégats.
Pour comprendre ce processus, Tamara Rossy a construit un modèle physique qui rappelle le transport de molécules dans les systèmes fluidiques. A l’usage, elle a observé que des flux plus puissants peuvent fortement contrarier la capacité des bactéries à nager sur une surface et la coloniser, avec pour résultat des colonies éparpillées.
Résulats contre-intuitifs
Toutefois, certains résultats ont été contre-intuitifs. «Des intensités de flux élevées diminuent probablement la capacité de bactéries en train de nager à envahir des colonies existantes», observe la chercheuse. «Pour pouvoir croître dans de tels flux puissants, les cellules individuelles comptent sur l’attachement immédiat à des cellules-sœurs proches de leurs cellules-mères.»
De puissants flux vont également ségréguer les deux populations, avec des effets potentiellement puissants sur la dynamique sociale générale entre les bactéries hôtes d’un biofilm. «Que les flux soient faibles ou forts importe réellement pour l’arrangement et la structure du biofilm», souligne Alexandre Persat. «Cela montre que les flux et, plus généralement, l’environnement physique des biofilms peuvent affecter l’histoire évolutionnaire d’une espèce de bactéries; cela est vrai au moins pour différents clones de bactéries tels que ceux que nous avons utilisés, mais il est très vraisemblable que ce principe s’applique à différentes espèces de bactéries.»
«Les biofilms sont une facette vraiment fascinante et importante de la vie microbienne», conclut-il. «C’est aujourd’hui seulement que nous mesurons combien les principes physiques conditionnent leur architecture et comment cela éclaire la physiologie bactérienne et l’évolution. Mais nous n’avons guère que gratté la surface - il y a encore tant à apprendre !»
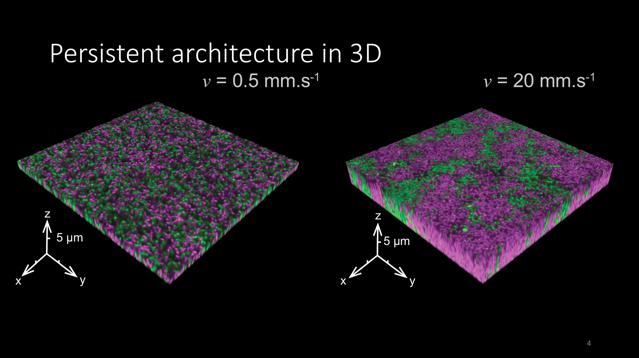
Impact d’intensités de flux faibles et élevées sur le mélange de deux clones de Caulobacter crescentus (rose et vert). Crédit: Tamara Rossy (EPFL).
Fonds National Suisse
Fondation Giorgi-Cavaglieri
National Science Foundation
Dartmouth College (Prix Burke)
Cystic Fibrose Foundation
National Institutes of Health
Tamara Rossy, Carey D. Nadell, Alexandre Persat. Cellular advective-diffusion drives the emergence of bacterial surface colonization patterns and heterogeneity. Nature Communications, 6 juin 2019, DOI: 10.1038/s41467-019-10469-6